| Advertentie | |
|
|
|
|
|
|
|
Kijk eens op http://www.environmentalchemistry.com onder het periodiek systeem (waar je dus van elk element een schema ziet).
Zo moeilijk is het tekenen van elektronenschillen overigens niet, dit hangt af van de kwantumgetallen Wat je in ieder geval moet weten van de elektronen is het hoofdkwantumgetal en voor de simpele opvulling is het vierde kwantumgetal spinkwantumgetal nodig. Dit klinkt veel moeilijker dan het is: het hoofdkwantumgetal zegt gewoon in welke schil het elektron zit. Misschien heb je dit in de lessen aangegeven met K, L, M, N, O, P, Q-schil. Om de twee systemen om te zetten: voor K is n=1, voor L is n=2 enzovoorts. Hierbij geldt dat elke schil maar 2n^2 (2 maal het kwadraat van het hoofdkwantumgetal) en dat in de buitenste schil slechts 8 elektronen. dat vierde kwantumgetal is de spin van je elektron. Hiervan zijn er twee waarden spin-up en spin-down. Hierbij geldt vooral de regel van Hund die vertelt hoe we alles moeten ordenen. De regel van Hund zegt enkel dat in eenzelfde energieniveau (=schil) de elektronen zo veel mogelijk eenzelfde spin hebben. Kortom, je moet eerst alle elektronen in spin-up (of spin-down; dat maakt niet uit) invullen en dan alles in de andere spin. Het gevolg hiervan is de vorming van elektronenwolken: twee elektronen worden pas een elektronenpaar als ze een tegengestelde spin hebben. Dat is de theorie, nu de praktijk: in de eerste schil passen 2 elektronen, vul deze dus op. Je kan geen paren maken. In de schil daarbuiten passen er 8. De volgende schil kan er 18 bevatten, maar let op, vermits deze de buitenste is bij de opvulling, moet je er eerst 8 insteken. Dan ge je naar de volgende schil die vul je ook tot 8 elektronen. Dan ga je terug naar je derde schil, waar er nu 18 op passen omdat deze niet meer de buitenste is. Ga nu voor met de buitenste schil, waar geen elektronen zijn. Daarmee kan je dus voortgaan, dus steeds opvullen tot 8, naar de volgende tot 8 opvullen en teruggaan naar de vorige om verder op te vullen tot 18, 32, ... Let er nu wel op, dat je niet altijd 8 elektronen hebt om alles op te vullen. In dat geval, moet je eerst 4 vrije elektronen tekenen en dan de rest bijvullen. Stel dat je 5 elektronen overhebt voor de buitenste schil, heb je 4 eenzame elektronen en eentje over. Dat laatste elektron komt bij een van de eenzame elektronen zodat je 3 vrije elektronen hebt en 1 elektronenpaar. Voor deze atomen zou dat:    Ik hoop dat je mijn uitleg een beetje begrijpt, het is handiger om het met tekeningen uit te leggen, maar daar heb ik geen tijd voor.
__________________
vaknar staden långsamt och jag är full igen (Kent - Columbus)
|
|
|
|
|
|
nee jullie hebben het fout: rutherford ontdekte dat atomen bestaan uit een positieve kern met daaromheen een wolk van negatieve elektronen. Later is dit model verfijnd door Bohr door te zeggen dat deze elektronen zich in de schillen zoals we die nu kennen gerangschikd zijn.
eerst kwam dus Rutherford met het feit dat de kern bestaat uit protonen en daaromheen een wolk van elektronen. Daarna stelde Chadwick dat de kern ook uit neutronen bestaat en vervolgens kwam Bohr met de stelling dat de elektronen zich in vaste energieniveau's (schillen) om de kern vliegen. http://sevenodd.com/projects/atomic_...htm#rutherford op deze site zie je de ontwikkeling: Ernest Rutherford (1871 - 1937) Discovered the nucleus in 1908. Found the nucleus to be positively charged. Envisioned the atom as having a positively charged nucleus and electrons scattered around the edge. Neils Bohr (1885 - 1962) Proposed the Planetary Model in 1913 (also called the Bohr Model). Worked in conjunction with Rutherford at Manchester from 1912-1919, during most of these years, World War I was taking place (1914-1918). Laatst gewijzigd op 02-12-2004 om 20:48. |
|
|
|
||
|
Citaat:
Op die site staat het zelf, een voorbeeld van het Rutherfordmodel: 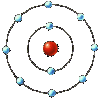 http://sevenodd.com/projects/atomic_...rutherford.gif Bohr had ongeveerd hetzelfde, hij voegde orbitalen toe en zei dat elektronen op eenzelfde schil tot eenzelfde energieniveau behoorden.
__________________
vaknar staden långsamt och jag är full igen (Kent - Columbus)
|
||
|
|
||
|
Citaat:
Blijkbaar was Rutherford ook bezig met een atoommodel waar alle elektronen in een schil zitten zoals de planeten. Overigens zitten de elektronen ongeordend rond het atoom, er liggen wel enkele beperkingen op, maar het is niet zo dat ze mooi op die banen blijven 
__________________
vaknar staden långsamt och jag är full igen (Kent - Columbus)
|
||
| Advertentie |
|
|
 |
«
Vorige topic
|
Volgende topic
»
|
|
Alle tijden zijn GMT +1. Het is nu 06:06.






 Adverteren
Adverteren